Sustainable Disease Control(SDC)達成を目指したDME治療
Ophthalmology Web Conference
開催日:2024年3月26日

長岡 泰司 先生
旭川医科大学
眼科学講座
糖尿病黄斑浮腫(DME)の治療変遷
黄斑レーザー光凝固術は、視力の悪化を防ぎ、視力の安定化に有効であることが1985年に報告されている1)。2000年代に抗VEGF薬が登場するまでは、レーザーで視力の悪化を防ぐことがDME治療の主軸であったが、侵襲的な治療であるという側面は否めなかった。その後、レーザー光凝固術に対する抗VEGF療法の有用性を最初に示したアイリーア(2mg)の第Ⅱ相試験であるDA VINCI試験2)が報告され、視力維持から視力改善が期待されるようになった。また、第Ⅲ相臨床試験であるVIVID/VISTA-DME試験3)でも、主要評価項目(検証的な解析)においてレーザー治療群に対するアイリーア(2mg)の優越性が検証された(p<0.0001 vs. レーザー治療群、ANCOVA)。アイリーア(2mg)投与群では、4週ごと5回連続の導入期を設けた上で、8週ごとあるいは4週ごとの投与が行われたが、100週目における最高矯正視力(BCVA)文字数のベースラインからの変化量の平均値は、8週ごと投与群で+9.4~11.1文字、4週ごと投与群で+11.4~11.5文字を示した。これらの結果を踏まえ、現在のDME治療は抗VEGF療法が一般的となっている。
DMEにおける抗VEGF療法の課題
抗VEGF薬を導入期3回連続投与後、PRN(Pro renata)投与で3年間治療を続けても、約40%が治療抵抗性であったことが報告されている4)。抗VEGF療法を行う患者の経済的負担を考えると、このような治療抵抗性DMEの存在は費用対効果の面で課題が残る。
さらに、抗VEGF療法の経済的問題は治療中断につながる可能性が示唆されることから、日本国内の眼科医の多くが問題視しており5)、持続可能な治療を考えるうえでも重要な課題となっている。
DME患者において治療中断は視力予後に影響し、治療を再開しても浮腫は改善する一方で視力改善は限定的であることが報告されている6,7)。治療中断により浮腫が遷延することで視細胞を含む網膜外層構造が障害され視力回復が得にくくなると言われている。また、DME治療では浮腫と視力が必ずしも一致しない8)。網膜内層の薄さと視力改善が正に相関するのに対し、網膜外層では逆の相関関係、つまり、網膜外層が薄くなると視力の悪化が認められた9)。これらのことから、網膜外層が薄くなると不可逆的な視力障害が残るため、網膜外層への影響を防ぐことが、持続可能な治療ならびに視力を良好な状態で維持するためにも重要と考えられる。
持続可能なDME治療とアイリーア8mgへの期待
DME治療において、疾患活動性を示す血管新生や血管透過性亢進などを持続的にコントロールし、長期的な視力低下を防ぐことが重要であり、Sustainable DiseaseControl(SDC)はその治療達成を目指した治療目標である。SDC達成に求められる基準は、改善した視力を長期に維持できること、Fluidを速やかに減少させて長期に維持できること、負担軽減により治療が継続できることである。
DME患者は、就労等に伴う時間的な問題や地理的な環境から、しばしば通院が困難になる場合があり、SDCにおいて投与間隔の延長は特に重要だと感じている。また、抗VEGF療法により速やかに浮腫を軽減させるということは、すなわち早期反応性が得られることであり、抗VEGF薬投与後の早期反応性は視力変化における予後予測の観点10)、後々の浮腫のコントロールの観点11)からも重要であることが報告されている。
持続可能とする理想的なDME治療は、治療効果に加えて速やかなFluidコントロールと長い持続時間が重要であり、安全性を含めたすべての要素を満たす治療法が期待される。アイリーア8mgはアフリベルセプト2mgと比較して投与間隔を約20日間延長できると予測され(図1)、投与間隔延長を目的に開発された。
図1|ヒト硝子体内における遊離型アフリベルセプト濃度-時間プロファイルのシミュレーション†
(MMRM、FAS)

†
照会事項への回答
バイエル薬品社内資料[海外第Ⅱ相試験:CANDELA試験]承認時参考資料
バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:PULSAR試験]承認時評価資料
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
DME患者を対象とした第Ⅱ/Ⅲ相国際共同試験であるPHOTON試験12)では、アイリーア8mg12週間隔または16週間隔投与による有効性についてアフリベルセプト2mg8週間隔投与に対する非劣性を検証するとともに、安全性についても検討した。本試験で設定された導入期の投与回数は、アフリベルセプト2mgは5回、8mgは3回であった。アイリーア8mg投与群は16週目以降DRM(doseregimen modifi cation)基準に合致した場合には投与間隔を最短8週ごとに短縮することが可能とされ、2年目以降は投与間隔の延長も可能とされた。
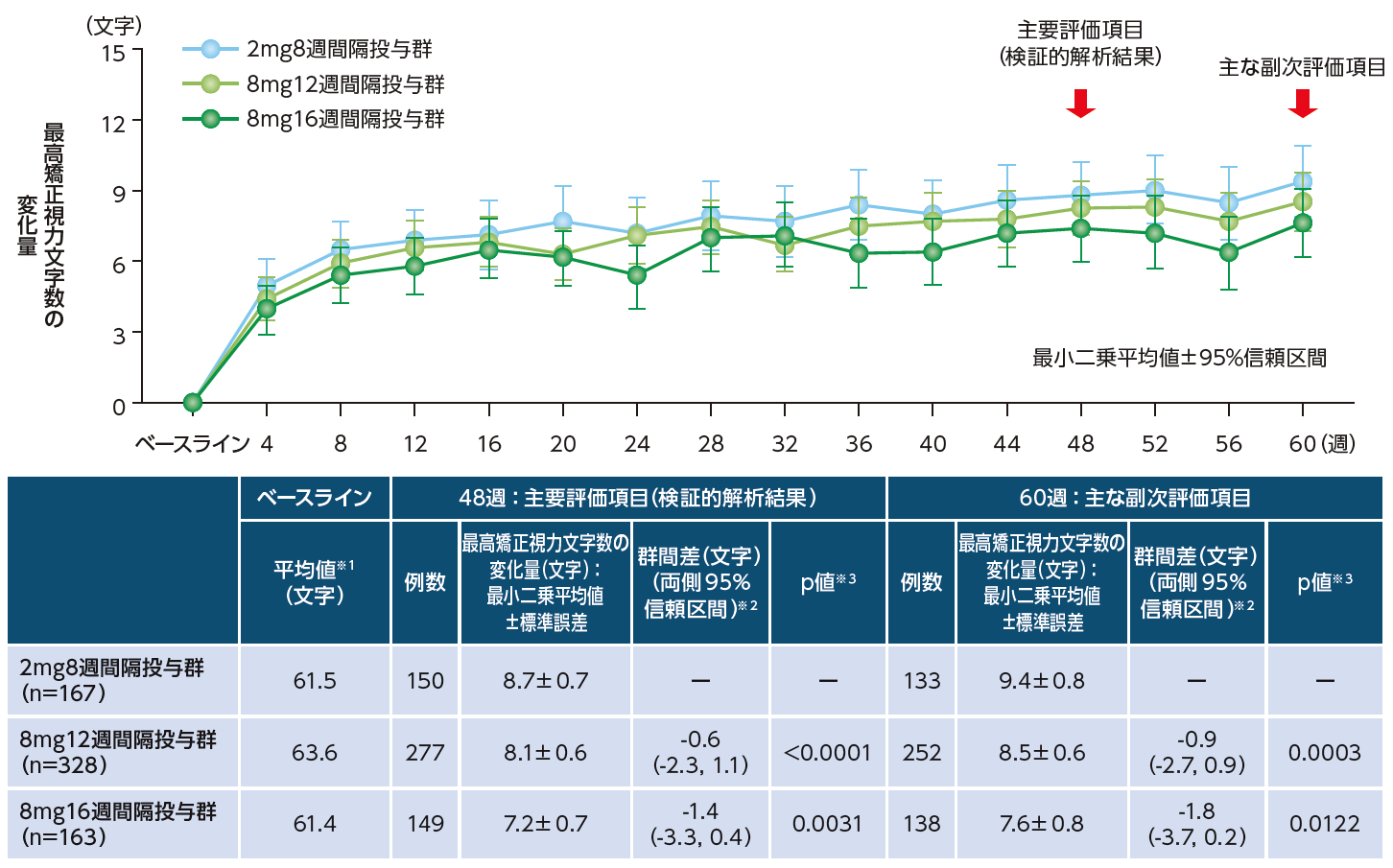
主要評価項目(検証的な解析)である48週目におけるBCVAのベースラインからの変化量(最小二乗平均値)は、アイリーア8mg12週間隔投与群で+8.1文字、8mg16週間隔投与群で+7.2文字、2mg8週間隔投与群で+8.7文字であり、8mg12週間隔投与群および8mg16週間隔投与群の2mg8週間隔投与群に対する非劣性が検証された(図2)。48週目においてBCVAが69文字以上であった患者の割合は、8mg12週間隔投与群で65.3%、8mg16週間隔投与群で62.6%、2mg8週間隔投与群で63.0%であった。
図2|BCVAのベースラインからの変化量[48週:主要評価項目(検証的解析結果)、60週:主な副次評価項目]
(MMRM、FAS)
※1
実測値
※2
各群ー2mg8週間隔投与群
※3
非劣性(非劣性限界値-4文字)の片側検定
●
MMRM(mixed model for repeated measurements):反復測定混合効果モデル。ベースラインの最高矯正視力文字数を共変量、投与群、来院および層別因子[ベースラインのCRT(400μm未満、400μm以上)、過去のDME治療(あり、なし)および地域(日本、その他の地域)]を固定効果とし、ベースラインの最高矯正視力文字数と来院の交互作用項、投与群と来院の交互作用項を含む。
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
48週目における中心網膜厚(CRT)のベースラインからの変化量(最小二乗平均値)は、8mg12週間隔投与群で-176.8μm、8mg16週間隔投与群で-148.8μm、2mg8週間隔投与群で-164.9μmであった。
48週目における投与間隔は、8mg12週間隔投与群では91.0%の患者が12週間隔投与を維持、8mg16週間隔投与群では、89.1%の患者が16週間隔投与を維持していた(図3)。また、48週目における平均投与回数は、8mg12週間隔投与群で5.7回、8mg16週間隔投与群で4.9回、2mg8週間隔投与群で7.7回であった(図4)。
図3|投与間隔
8mg12週間隔投与群において48週目まで投与間隔 が12週間隔以上であった患者の割合(SAF※1)
[探索的評価項目]

8mg16週間隔投与群において48週目まで投与間隔 が16週間隔以上であった患者の割合(SAF※1)
[探索的評価項目]

48週目までに投与間隔が短縮となった患者の割合、次回予定された投与間隔別の患者の割合(SAF※1)
[事前に規定されたその他の評価項目]

例数(%)
※1
SAFのうち48週目までの投与を完了した患者のみ
※2
12週間隔までしか短縮されなかった患者、および12週間隔まで短縮され、さらに8週間隔まで短縮された患者を含む
※3
48週目までの最終来院日における評価に基づく投与間隔
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
図4|48週までの投与回数[事前に規定されたその他の評価項目]
投与回数※(試験眼、SAF)
![図4:PHOTON試験:48週までの投与回数[事前に規定されたその他の評価項目]](/sites/g/files/vrxlpx7866/files/2024-08/ts_8mg_dme_webcon20240326_img04.png)
※
偽注射を除く投与回数
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
アイリーア8mgは投与容量が70μLであることから、眼圧上昇の発現、高濃度製剤であることから、眼局所での眼内炎症等や全身における動脈血栓塞栓症等の発現が懸念された。PHOTON試験の安全性について、試験眼の有害事象としては、眼圧上昇事象が8mg12週間隔投与群で11例(3.4%)、16週間隔投与群で1例(0.6%)、2mg8週間隔投与群で7例(4.2%)に、眼内炎症反応はそれぞれ4例(1.2%)、1例(0.6%)、1例(0.6%)に認められた。また、全身性の有害事象として、高血圧事象が8mg12週間隔投与群で42例(12.8%)、16週間隔投与群で28例(17.2%)、2mg8週間隔投与群で23例(13.8%)に、APTC(Antiplatelet Trialists' Collaboration)定義による動脈血栓塞栓事象はそれぞれ13例(4.0%)、9例(5.5%)、6例(3.6%)に認められた。
まとめ
DME治療の第一選択は抗VEGF療法であるが、治療抵抗性DMEの存在や経済的負担、治療中断による視力予後不良などの課題も存在する。アイリーア8mgは、投与間隔を延長し患者負担を減少させることが期待でき、特に就業者や近隣に黄斑疾患に対する専門病院がない地方在住者など、様々な要因により頻回な通院が困難な患者にとっては有用な治療選択肢になると考えている。アイリーア8mgは、SDCを達成するために求められる基準を満たすことが期待され、DME治療に寄与すると考えている。
文献
1)
Arch Ophthalmol 1985; 103(12): 1796-1806
2)
Do DV, et al.: Ophthalmology. 2011;118(9):1819-1826
3)
Korobelnik JF, et al.: Ophthalmology. 2014; 121(11): 2247-2254
4)
Bressler SB, et al.: JAMA Ophthalmol. 2016; 134(3): 278-285
5)
Sugimoto M, et al.: J Diabetes Investig. 2019; 10(2): 475-483
6)
Matsunaga DR, et al.: Am J Ophthalmol. 2022; 233: 1-7
7)
Kim JS, et al.: Sci Rep. 2021; 11(1):18353
8)
Diabetic Retinopathy Clinical Research Network.: Ophthalmology. 2007; 114(3): 525-536
9)
Ebneter A, et al.: Retina 2016; 36(7): 1314-1323
10)
Bressler NM, et al.: Am J Ophthalmol. 2018: 195: 93-100
11)
Minami Y, et al.: BMC Ophthalmol. 2017; 17(1): 28
12)
バイエル薬品社内資料[日本人を含む第Ⅱ/Ⅲ相国際共同試験:PHOTON試験]承認時評価資料
座長コメント
本邦において2012年から10年以上の使用経験を有するアイリーア(2mg)の高濃度製剤としてアイリーア8mgが登場した。SDCの達成を目指し、投与間隔の延長を含めた負担軽減により継続的な治療を行ううえで、アイリーア8mgを用いたPULSAR試験、PHOTON試験の結果は、日常診療の参考となると考えられる。

石田 晋 先生
北海道大学大学院
医学研究院 眼科学教室



