日本人を含む第Ⅲb相国際共同試験:FIREFLEYE NEXT試験
(長期安全性および視機能の評価)[中間解析、1歳時]
バイエル薬品社内資料[日本人を含む第Ⅲb相国際共同試験:FIREFLEYE NEXT試験]承認時評価資料
アイリーア(2mg)の承認された効能又は効果(抜粋):未熟児網膜症*
アイリーア(2mg)の承認された用法及び用量(抜粋):
〈未熟児網膜症〉
アフリベルセプト(遺伝子組換え)として1回、0.4mg(0.01mL)を硝子体内投与する。なお、必要な場合は再投与できるが、1ヵ月以上の間隔をあけること。
*
本適応症は「アイリーア®硝子体内注射液40mg/mL」の効能又は効果として承認されています。「アイリーア®硝子体内注射用キット40mg/mL」の効能又は効果としては承認されていません
本ページでは「アイリーア(2mg)」を「アイリーア」と記載しています。
試験概要

【実施地域】FIREFLEYE NEXT試験:アジア太平洋地域(日本含む)、欧州、ラテンアメリカ、中東の24ヵ国、55施設
目的
FIREFLEYE試験で試験治療を受けたROP患者を対象に、アイリーアの長期安全性、視機能、および発達全般について検討する
対象
データカットオフ時点※1で本試験に組入れられたROP患者89例(うち日本人:11例)
[主な選択基準]
- FIREFLEYE試験で試験治療を受けた
- 暦年齢が13ヵ月未満 など
[除外基準]
本試験への参加または試験手順の実施を妨げる医学的状態を有する
デザイン
非無作為化非遮蔽網膜光凝固術対照比較試験
投与方法
FIREFLEYE NEXT試験では試験治療を行わなかった。なお、ROPに対する治療が必要となった場合、治験担当医師の判断により各国の標準治療に従って試験治療以外の治療を実施できた。

a)スクリーニング/追跡調査開始時来院は、FIREFLEYE試験の24週目の来院日または最終追跡調査来院日のうちいずれか遅い方の日と同日、もしくはこの日から患者の暦年齢が13ヵ月になるまでの期間のいずれかとした。
b)承認事項一部変更承認申請時において評価時点未達
主な有効性評価項目
主要評価項目:
5歳時の両眼視での最高矯正視力(Snellen換算スコア)
副次評価項目:
- 1、3および5歳時に不良な形態学的転帰(網膜剥離、黄斑牽引、黄斑皺襞または水晶体後部組織)を認めた患者の割合※2
- 1歳時に活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合
- 本試験中にROPの治療を要した患者の割合
- 本試験中に眼科治療を要した患者の割合 など
事前に規定したその他の評価項目:
- 5歳時までの視機能および屈折ならびに形態学的転帰の評価※2,3
- 5歳時までの斜視検査結果の解析※2,4
- 国際新生児コンソーシアムが提言したROP活動スケールに基づくROPの転帰の評価※5
- 5歳時までの倒像検眼鏡検査に基づき血管の発達の完了を認めた患者の割合※2 など
主な安全性評価項目
有害事象、重篤な有害事象、投与中止に至った有害事象、死亡、理学的検査 など
解析計画
探索的な解析
主要評価項目(本試験に組入れられた患者)
副次評価項目(本試験に組入れられた患者)
事前に規定したその他の評価項目(本試験に組入れられた患者)
※1 本試験に組入れられた患者の50%以上で、1歳時データが得られた時点をデータカットオフ日とした。
※2 1歳時の結果を掲載
※3 視機能、調節麻痺下での屈折検査
※4 眼球運動
※5 FIREFLEYE試験の試験治療開始時からFIREFLEYE NEXT試験の追跡調査開始時までのROP活動スケールの変化量、FIREFLEYE試験の試験治療開始時から1歳時までのROP活動スケールの変化量
試験対象例数と各群の患者の内訳

患者背景および特性(本試験に組入れられた患者)

※ FIREFLEYE試験での試験治療開始時の月経後年齢=FIREFLEYE試験での出生時の在胎期間+FIREFLEYE試験での試験治療開始時の暦年齢

例数(%)または眼数(%)
※1 ROPの病期(zoneおよびstage)がより進行している眼に基づき分類した。
より進行している眼の選択基準:AP-ROPまたはzoneがより低い眼とし、同じ場合はstageがより高い眼を選択した。
主要解析に適合する眼のみ示した。
※2 FIREFLEYE試験で試験治療を受けた眼のみ示した。
※3 AP-ROP患者を除く。
5歳時の両眼視での最高矯正視力(Snellen換算スコア)(本試験に組入れられた患者):主要評価項目
承認事項一部変更承認申請時において試験実施中のため、申請時にデータは得られていない。
1歳時に活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合は、アイリーア投与群で97.4%、レーザー治療群で90.5%でした
1歳時に活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合※
(1歳時来院を完了した患者):副次評価項目
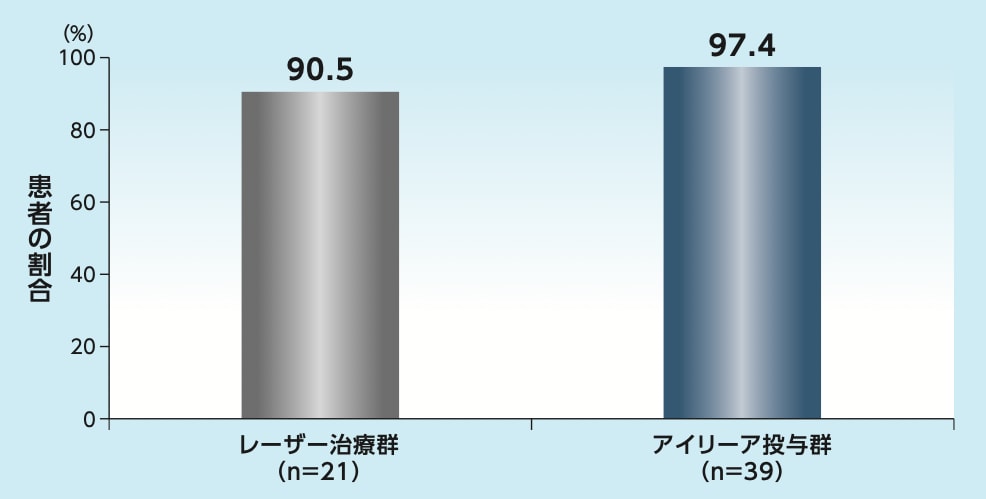
※ 活動性のROPを治療を要するROP(FIREFLEYE試験の基準に従う)と定義し、不良な形態学的転帰を網膜剥離、黄斑牽引、黄斑皺襞または水晶体後部組織と定義した。
両眼が適格眼の場合には両眼ともに該当する患者とした。
1歳時での不良な形態学的転帰は、アイリーア投与群では認められず、レーザー治療群で1例(4.8%)に網膜剥離が認められました
1、3および5歳時に不良な形態学的転帰(網膜剥離、黄斑牽引、黄斑皺襞または水晶体後部組織)を認めた患者の割合※(1歳時来院を完了した患者):副次評価項目

※ 各眼に対して複数の不良な形態学的転帰の報告が可能であった。
1歳時に血管の発達の完了を認めた眼の割合は、アイリーア投与群で69.3%、レーザー治療群で47.5%でした
5歳時までの倒像検眼鏡検査に基づき血管の発達の完了※1を認めた患者の割合※2
(1歳時来院を完了した患者):事前に規定したその他の評価項目

※1 鋸状縁から1乳頭径以内までの周辺網膜血管の発達の完了
※2 本評価項目は患者の割合を示すことが規定されているが、中間解析では患者の割合が算出されていないため、ここでは眼の割合を示す。
解析には本試験のデータだけでなくFIREFLEYE試験で得られたデータも含めた。
FIREFLEYE NEXT試験(1歳時まで)における安全性
(本試験に組入れられた患者)
有害事象発現率
アイリーア投与群で60例中56例(93.3%)、レーザー治療群で29例中26例(89.7%)に認められました
主な有害事象
アイリーア投与群:発熱10例(16.7%)、近視9例(15.0%)
レーザー治療群:乱視6例(20.7%)、近視、網膜出血 各5例(17.2%)、斜視、結膜炎、臍ヘルニア 各3例(10.3%)
試験薬に関連する重篤な有害事象
アイリーア投与群:網膜剥離1例
レーザー治療群:網膜剥離1例
試験薬に関連する投与中止に至った有害事象、試験薬に関連する死亡
本試験においては認められませんでした
出生日+365日までに発現した事象を示した(集計結果にはFIREFLEYE試験において発現した有害事象を含めた)。
ROPに対するアイリーアの効能又は効果、用法及び用量
【4】効能又は効果
未熟児網膜症
【5】効能又は効果に関連する注意
〈未熟児網膜症〉
- 5.4
- 自然治癒が期待できる軽症例及び外科的手術の適応となる重症例における本剤の投与意義が明確ではないことから、本剤による治療を開始するに際し、患者の状態や病変の位置、病期、病型による重症度等を考慮し、本剤投与の要否を判断すること。[17.1.13参照]
【6】用法及び用量
〈未熟児網膜症〉
アフリベルセプト(遺伝子組換え)として1回、0.4mg(0.01mL)を硝子体内投与する。なお、必要な場合は再投与できるが、1ヵ月以上の間隔をあけること。
【7】用法及び用量に関連する注意
〈未熟児網膜症〉
- 7.8
- 本剤投与により治療反応が得られた後に、疾患活動性の増加を示唆する所見が認められた場合は、本剤の再投与を検討すること。[17.1.13 参照]
- 7.9
- 本剤投与後早期に治療反応が得られない場合は、他の治療への切替えを考慮すること。[17.1.13参照]
アイリーア®硝子体内注射液40mg/mL 電子添文 2024年12月改訂(第5版)より抜粋
レーザー光凝固治療と抗VEGF療法のそれぞれの利点、欠点を考慮し、家族に説明のうえ、抗VEGF療法を初回治療とする症例を選択することが望まれます
レーザー光凝固治療と抗VEGF療法の利点・欠点

未熟児網膜症眼科管理対策委員会:未熟児網膜症に対する抗VEGF療法の手引き(第2版), 日眼会誌. 2023; 127: 570-578. より作表
ROP患者への硝子体内注射時には成人患者との違いに注意が必要です
硝子体内注射手技の違い

※ 日本人を含む第Ⅲ相国際共同試験(FIREFLEYE試験)においては、硝子体内投与時の注射針の刺入部は角膜輪部から1.0~2.0mmとした。
未熟児網膜症眼科管理対策委員会:未熟児網膜症に対する抗VEGF療法の手引き(第2版), 日眼会誌. 2023; 127: 570-578. より一部改変
硝子体内注射後は慎重かつ長期的な経過観察が必要です
眼底検査の頻度は、ROPの病型や重症度、患児の全身状態、施設の管理方法との兼ね合いで決定します
経過観察の目安

未熟児網膜症眼科管理対策委員会:未熟児網膜症に対する抗VEGF療法の手引き(第2版), 日眼会誌. 2023; 127: 570-578.
FIREFLEYE試験およびFIREFLEYE NEXT試験の臨床データパッケージ

※1 FIREFLEYE試験では試験治療を受けた患者の例数、FIREFLEYE NEXT試験ではデータカットオフ時点でFIREFLEYE NEXT試験に組入れられた患者の例数を示す。
※2 FIREFLEYE試験では、いずれの群においても試験治療期間中に規定された基準を満たした場合、無作為割り付けされた治療法による再投与、再治療またはレスキュー治療(アイリーア投与群では網膜光凝固術によるレーザー治療、レーザー治療群ではアイリーア投与)を行うことができた。FIREFLEYE NEXT試験では、試験治療は実施しなかった。
1)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:FIREFLEYE試験]承認時評価資料
2)バイエル薬品社内資料[日本人を含む第Ⅲb相国際共同試験:FIREFLEYE NEXT試験]承認時評価資料
アイリーアは、VEGFによる異常な網膜血管の増殖抑制をすることで、ROPに適応を持つVEGF阻害剤です
1.
アイリーアは、VEGFを阻害し1)、異常な網膜血管の増殖を抑えることで、ROPを治療することを目的として適応を取得した薬剤です
2.
FIREFLEYE試験において、日本の有効性主要解析について、投与24週目における奏効割合はアイリーア投与群で82.7%であり、アイリーア投与群における奏効割合の両側95%信頼区間の下限値は72.2%で、事前に規定した閾値(66%)を超えており、奏効割合の閾値に対するアイリーア投与群の優越性が検証されました(検証的解析結果)2)
3.
FIREFLEYE試験において、日本以外の国または地域の有効性主要解析について、投与24週目における奏効確率はアイリーア投与群で85.5%であり、レーザー治療群に対するアイリーア投与群の群間差が‒5%以上となる確率は88.4%で、事前に規定した基準(95%以上)を下回っており、レーザー治療群に対するアイリーア投与群の非劣性は検証されませんでした(検証的解析結果)2)
4.
FIREFLEYE NEXT試験において、1歳時に活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合はアイリーア投与群で97.4%でした3)
5.
FIREFLEYE試験(24週間)において、副作用はアイリーアを投与された79例(アイリーア投与群75例、レーザー治療群4例)中17例(21.5%)に認められました2)
主な副作用
結膜出血4例(5.1%)、網膜出血、注射部位出血、眼圧上昇 各3例(3.8%)試験薬に関連する重篤な有害事象
網膜剥離1例(レーザー治療群)試験薬に関連する投与中止に至った有害事象、試験薬に関連する死亡
本試験においては認められませんでした
6.
FIREFLEYE NEXT試験(1歳時まで)において、有害事象はアイリーア投与群で60例中56例(93.3%)に認められました3)
主な有害事象
発熱10例(16.7%)、近視9例(15.0%)試験薬に関連する重篤な有害事象
網膜剥離2例(アイリーア投与群1例、レーザー治療群1例)試験薬に関連する投与中止に至った有害事象、試験薬に関連する死亡
本試験においては認められませんでした
7.
重大な副作用注)として、眼障害(眼内炎、眼圧上昇、硝子体はく離、外傷性白内障、網膜出血、網膜色素上皮裂孔、硝子体出血、網膜はく離、網膜裂孔、網膜色素上皮はく離)、脳卒中、主な副作用として結膜出血、眼痛などがあらわれることがあります。
電子添文の副作用および臨床成績の安全性の結果をご参照ください。注)投与手技に起因する有害事象を含む。
1)Papadopoulos N, et al.: Angiogenesis 2012; 15: 171-185.
利益相反:本論文の著者全員がRegeneron Pharmaceuticals社の社員である。
2)バイエル薬品社内資料[日本人を含む第Ⅲ相国際共同試験:FIREFLEYE試験]承認時評価資料
3)バイエル薬品社内資料[日本人を含む第Ⅲb相国際共同試験:FIREFLEYE NEXT試験]承認時評価資料



